
대장균에서 단백질을 발현할 때
많은 사람들이 고통받는 것!
단백질들 자체는 많이 만들어지는데
대개 불용성 분획,
즉, inclusion body가 형성되는 것입니다.
Inclusion body는
왜 만들어질까요?
Inclusion body의 생성원인은
이종 단백질의 과다 발현 및
대체로 misfolding에 의한 것으로 알려져 있습니다.
*이종 단백질의 과다발현
: 대장균에서는 매 35초 마다 하나의 단백질이
리보솜에서 발현, 배출되며
단백질의 농도가 300~400 mg/mL에 도달할 때
대장균의 재접힘 기능은 한계에 도달함.
단백질의 misfolding으로 인해
hydrophobic interation이 증가하여
aggregation이 되는 것이죠.
그 외에도
발현하고자 하는 단백질 자체의 특성
때문일 수도 있습니다.
예를 들어,
1. Disulfide bond가 많이 존재하는 경우
2. Post-translational modification이
필수적인 단백질의 경우
대장균과 진핵생물은 산화환경 환경이
다르기 때문에
고려할 사항이 많죠.
그렇다면,
inclusion body를 줄이기 위해서는
어떤 방법을 사용할 수 있을까요?
1. 낮은 온도
즉,
단백질이 천천히 만들어지면
correct folding이 될
가능성이 높아지기 때문입니다.
(이때, 처음 배양할 때부터
저온으로 키운다면 세포성장이
너무 느리기 때문에
37 ℃에서 키운 후에
induction 시 온도를 낮추는 것을
권장합니다.)
2. IPTG 농도 및 시간 줄이기
Aggregation에 대한 kinetics를 보면
단백질의 농도가 높을수록
aggregation이 잘 생기기 때문에
IPTG와 같은 inducer의 농도를 낮추거나
induction time을 짧게 하는 방법이 있습니다.
3. Chaperon 단백질 사용
단백질의 입체구조를 돕는
단백질인 샤페론을 사용하면,
folding, unfolding, misfolding 등을
해결하여
리보솜에서 만들어지는
단백질이 응집되지 않고
정상적으로 folding 되도록 도와줍니다.
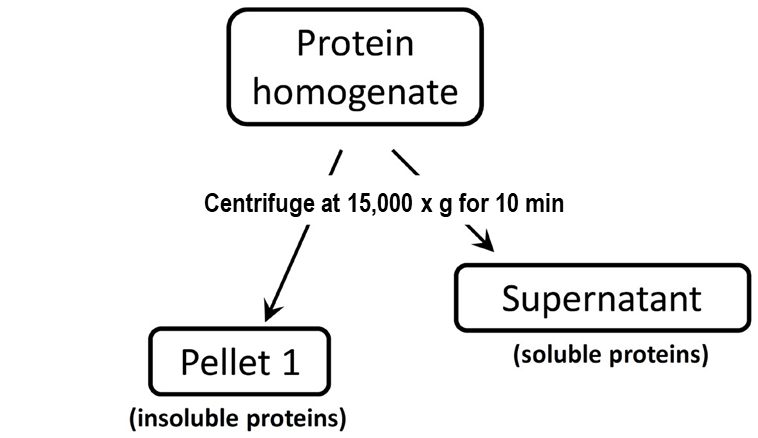
Inclusion body 획득 방법
위와 같은 방법 외에도
inclusion body가 생성되었을 때,
aggregation 되어 있는 단백질을
얻을 수 있을까요?
UREA 처리(6~8M)
Inclusion body 단백질은
단백질의 정상적인 3차적 구조를
가지고 있지 않기 때문에
활성이 없어서
고농도의 denaturants를 통해서만
풀림 작업이 가능합니다.
만약, SDS-PAGE에 loading하여
inclusion body를 확인하고 싶은 경우,
UREA 혹은 DW를 pellet과 1:1로 첨가,
dye를 넣고 끓여 denaturaton시켜
sample 5~10 μL 정도 loading 하시면
잘 확인하실 수 있을 것입니다.
이상
inclusion body가 왜 생기고
어떻게 해결할지
어떻게 inclusion body를 얻을 수 있는지
알아보았습니다.
'Experiment > Biochemistry Experiment' 카테고리의 다른 글
| [단백질] 단백질 연구 시 고려해야 할 사항 4편_단백질 환경 (Protein enviroment) (0) | 2023.06.13 |
|---|---|
| [단백질] 단백질 연구 시 고려해야 할 사항 3편_세정제 (Detergent) (0) | 2023.05.31 |
| [단백질] 단백질 연구 시 고려해야 할 사항 2편_환원제 (Reducing agents) (0) | 2023.05.25 |
| [단백질] 단백질 연구 시 고려해야 할 사항 1편_완충용액 (Buffers) (0) | 2023.05.23 |
| [분석] SDS-PAGE를 이용한 목적 단백질의 크기 분석_1편 (0) | 2023.05.03 |



